现金流持续为负、商业化未落地叠加内卷加剧,创新药企恒润达生闯关道阻且艰|IPO速递

政策红利下,创新药企得到发展,在此背景下企业上市热情高涨。近期,曾筹划境外上市的上海恒润达生生物科技股份有限公司(以下简称“恒润达生”),又瞄准科创板IPO。据招股书,由于尚未有产品上市,恒润达生收入“挂零”,三年半合计亏损超5亿元。
创新药企的发展根本是研发实力的较量,然而持续不断的投入加剧恒润达生资金链紧张,报告期内现金流持续为负。钛媒体APP注意到,如今恒润达生所处的免疫细胞治疗领域赛道内卷十分严重,不仅面临药物品种的直接竞争,还将与同适应症的其他药物展开竞争,恒润达生的资本化征程变得道阻且艰。
尚无上市产品,主营业务收入“挂零”
据了解,2015年7月20日,李国顺、上海寓庸、李国清、上海觉海和恒润研究所共同出资设立达生有限,这便是恒润达生的前身。
招股书显示,恒润达生是一家专注于突破性免疫细胞治疗产品研发与生产的创新生物医药公司,主要聚焦恶性血液病和实体肿瘤等治疗领域。成立至今,恒润达生搭建了完整的免疫细胞治疗研发生产体系,涵盖抗体筛选和验证平台、CAR结构设计平台、病毒载体规模化生产平台、细胞治疗产品规模化生产平台及质量检验放行平台等自主创新核心技术平台,形成了从早期研发到成熟临床试验阶段的在研管线布局。
截至招股说明书签署日,恒润达生已建立包含10个产品的11个研发管线,涉及2种细胞类型产品体系。其中,2项在研项目已处于II期注册临床试验阶段,2项在研项目处于I期注册临床试验阶段,以及多项应用了CAR-NK、DASH CAR-T等技术开发的在研管线处于临床前研究阶段。
具体而言,HR001治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)适应症被纳入CDE“优先审评审批程序”,已处于II期注册临床试验阶段,预计于2023年提交NDA;HR003治疗复发/难治性多发性骨髓瘤(r/r MM)适应症被纳入CDE“突破性治疗药物程序”,已处于II期注册临床试验阶段;HR001治疗复发/难治性CD19阳性B细胞急性淋巴细胞白血病(r/r CD19 阳性 B-ALL)适应症已处于I期注册临床试验阶段;HR004是 CD19-CD22 双靶点 CAR-T 细胞治疗产品,治疗复发/难治性B细胞急性淋巴细胞白血病(r/r B-ALL)适应症已处于I期注册临床试验阶段。
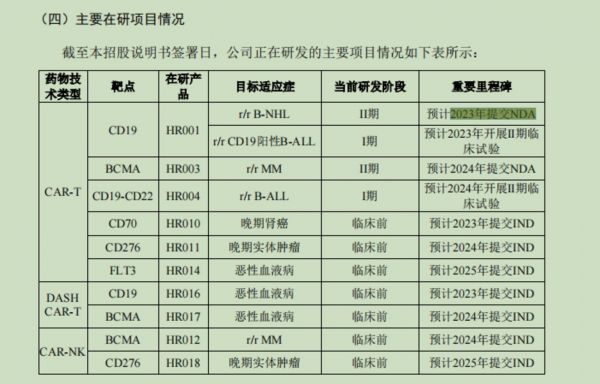
恒润达生在研项目情况,截取招股书
也就是说,此次闯关科创板的恒润达生,尚无产品上市销售,因此2020年、2021年以及2022年1-6月无收入。而2019年其他收入为19.47万元,来自于公司向苏州克睿基因生物科技有限公司提供了一批次实验用逆转录病毒收入。
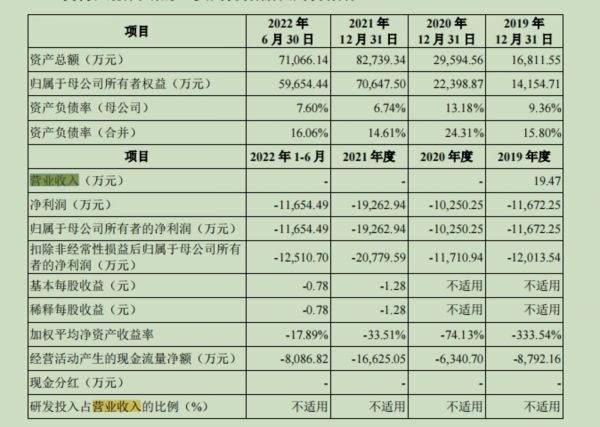
报告期内主要财务数据及财务指标,截取招股书
据招股书,2019年、2020年、2021年及2022年1-6月,恒润达生的归属净利润分别约为-1.17亿元、-1.03亿元、-1.93亿元和-1.17亿元,恒润达生三年半合计亏损超5亿元。截至报告期末,恒润达生的累计未分配利润约为-2.76亿元。未来一段时间内,该公司预期仍将存在累计未弥补亏损并持续亏损。
现金流持续为负,拟募资“补流”
恒润达生作为生物高科技企业,其产品竞争力主要依赖于公司研发水平。在市场竞争日益激烈的背景下,恒润达生也必须紧跟行业发展趋势,不断提高肿瘤免疫细胞治疗产品研发水平以保证和增强公司核心竞争力。
招股书显示,2019-2021年以及2022年1-6月,恒润达生的研发费用分别为8436.79万元、8459.53万元、16033.28 万元及9964.31万元。据介绍,恒润达生研发费用主要包括职工薪酬费用、临床试验费、折旧与摊销费用、材料费用等。各报告期,恒润达生计入研发费用的临床试验费分别为1214.22万元、1335.1万元、2379.95万元及1878.44万元,占研发费用的比例分别为14.39%、15.78%、14.84%及18.85%。2021年度,该公司临床试验费大幅增长主要系HR001治疗r/r B-NHL 适应症的管线于2021年进入临床二期入组阶段,临床中心增加、采购CRO等临床试验费用相应增加所致。2022年1-6月,临床试验费金额较大主要系 HR001临床入组例数增加,临床试验费用相应增加所致。
恒润达生坦言,随着公司在研管线研发进度的推进,未来仍需持续进行较大规模的研发投入,在可预见的未来将因此产生大量的经营亏损,对公司未来业绩可能存在不利影响。
而为了留住人才,恒润达生建立股权激励机制。报告期各期,该公司股权激励费用分别为1316.07万元、694.4万元、1786.17万元及 661.43万元。一边是持续投入研发,一边是股权激励,也加剧了恒润达生的亏损。数据显示,2019-2021年以及2022年1-6月,公司经营活动产生的现金流量净额分别为-8792.16万元、-6340.7万元、-16625.05万元及-8086.82万元。
恒润达生表示,公司在研管线的临床前研究、临床试验及商业化阶段均需要持续投入大量资金。公司如果无法在未来一定期间内保持足够的营运资金,将对在研管线的研发和商业化推进形成障碍,并对公司的业务前景、财务状况及经营业绩造成不利影响。
一位医药行业人士表示,创新药从来都是极度的“烧钱”,这种“烧钱”的程度如果不靠不断融资输血,很难支撑企业长久走下去。现有的融资渠道无法满足这种“烧钱”模式的需求,对于公司的经营管理造成挑战。因此,上市融资是必然选择。
据招股书披露,恒润达生拟募集资金25.39亿元,其中6亿元用于“补流”。
CAR-T市场竞争白热化,商业化“钱”景难料
智慧芽《医药生物产业系列——CAR-T细胞免疫治疗市场和创新技术研究报告》显示,全球在CAR-T细胞免疫疗法领域的专利申请目前约有2.1万件。其中,美国在CAR-T细胞疗法领域处于技术领先地位,中国则以明显领先于欧洲和日本的优势紧跟美国。
而据弗若斯特沙利文预测,2021年中国CAR-T市场规模约为2亿元,到2024年将增长至53亿元,至2030年市场规模有望达到289亿元。在该领域,中国还有望在未来短时间内弯道超车,占据全球市场更多份额。
值得注意的是,行业内卷十分严重。截至2022年6月30日,全球共有8款上市的CAR-T细胞治疗产品,其中国外上市的CAR-T细胞治疗产品包括 Kymriah, Yescarta, Tecartus, Breyanzi, Abecma 和 Carvykti,国内上市的CAR-T细胞治疗产品包括奕凯达以及倍诺达。2021年6月23日复星凯特的奕凯达在NMPA获批上市,成为中国首款获批上市的CAR-T细胞治疗产品。
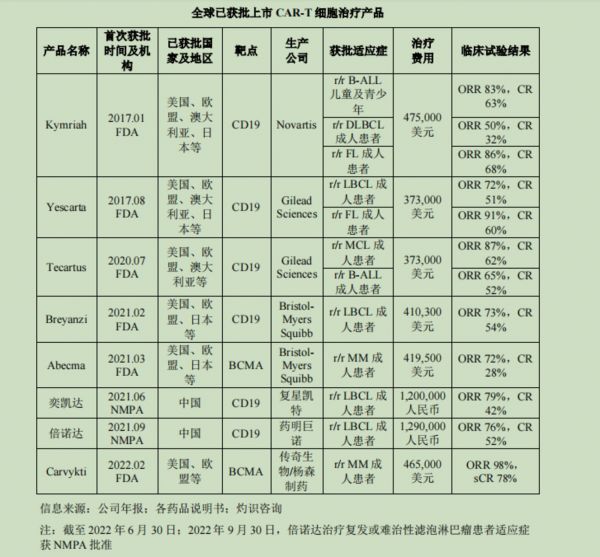
全球已获批上市 CAR-T 细胞治疗产品,截取招股书
据招股书,恒润达生进展最快的在研项目为HR001治疗 r/r B-NHL 适应症及HR003治疗 r/r MM适应症,已处于II期注册临床试验阶段。而目前国内已有针对 r/r B-NHL 的同类药物获批上市销售,已有针对 r/r MM 的同类药物提交NDA,且有多个同类药物处于不同的临床试验阶段。
也就是说,恒润达生的HR001、HR003 未来获批上市销售后,不仅面临与上述品种的直接竞争,还将与同适应症的其他药物展开竞争。相比HR001和HR003,已上市产品在市场推广、权威目录指南、医生用药习惯等方面的竞争优势,可能将加大公司产品面临的市场竞争难度。那么面对行业内卷严重,公司的核心竞争力是什么?带着前述疑问,钛媒体APP向恒润达生发去采访提纲,但截至发稿,未收到相关回复。
海南博鳌医疗科技有限公司总经理邓之东告诉钛媒体APP,近年来,细胞免疫疗法在肿瘤治疗方面成效显著,趋于成熟,尤其在血液瘤方面取得了可喜的效果,正逐渐成为患者防治肿瘤疾病的新选择和肿瘤疾病综合治疗的重要组成部分。但细胞免疫疗法的核心瓶颈是规模化量产和即时可及性。目前市面上的免疫细胞产品大都是患者自体细胞在体外扩增后回输,生产制备周期较长、价格相对昂贵、应用范围较局限。
据了解,CAR-T细胞治疗的流程通常包括从患者身上分离T细胞,对患者T细胞进行改造及体外扩增,最后将CAR-T细胞治疗产品回输入患者体内,从患者采血至回输通常需要3-4周,整个过程高度定制化、制备周期长、技术流程复杂、质量控制难度高。
另一方面,由于CAR-T细胞治疗的流程复杂,对医疗设施设备、医生及医护人员素质等治疗条件的要求较高,患者需前往医疗综合能力强、专业度高且具备相关资质的医院接受治疗,以及CAR-T细胞治疗产品在冷链物流及医院端管控要求高,全流程达到药品监管要求技术难度大,导致大规模产业化应用面临巨大技术挑战。这也意味着,即使恒润达生CAR-T细胞治疗产品上市,也存在商业化阶段无法实现大规模产业化的可能。
智慧芽《医药生物产业系列——CAR-T细胞免疫治疗市场和创新技术研究报告》显示,虽然中国CAR-T市场竞争白热化,但不容忽视的是在蓬勃发展的市场和技术背后,CAR-T细胞疗法仍面临不少挑战——副作用控制、实体瘤疗效、“天价”治疗费用等仍是全行业时下待攻克的焦点课题。(本文首发于钛媒体APP,作者|刘凤茹)
相关推荐
「闯关」FDA:新生代中国创新药企的「海外斗兽场」
毛利率连降,现金流持续为负,速度时空“跑单”背后缺底气|IPO速递
烧钱搞研发:康方生物二度闯关港股IPO
业绩回暖背后,华润啤酒高端战略路线道阻且艰
高毛利难持续、研发投入低于同行,G20峰会供应商盛邦安全闯关科创板|IPO速递
细胞免疫治疗撬动千亿市场 群雄逐鹿头部为王
22家AI创企复工背后:抗疫下的道阻与希望
深度长考:中国创新药触底了吗?
非洲修行第一年:谨慎乐观 道阻且长
恒瑞医药是时候走出“围城”了
网址: 现金流持续为负、商业化未落地叠加内卷加剧,创新药企恒润达生闯关道阻且艰|IPO速递 http://m.xishuta.com/zhidaoview27570.html