知料 | 划时代的细胞疗法上市,还隐藏着爆发力极强的行业机会
日前,复星凯特的阿基仑赛注射液(即抗人CD19 CAR-T细胞注射液,商品名:奕凯达)正式获得NMPA批准,成为国内首款上市的CAR-T疗法。
据介绍,这款细胞治疗产品将用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤。
所谓二线或以上系统性治疗,是针对一线治疗的一个概念,后者一开始对病人是起效的,但过段时间后就容易存在耐药性,导致肿瘤复发进展,因此会考虑其它的化疗或靶向药物进行治疗,这种治疗方案称为二线治疗。以此类推,如果二线治疗失效,会考虑三线治疗、四线治疗等等。
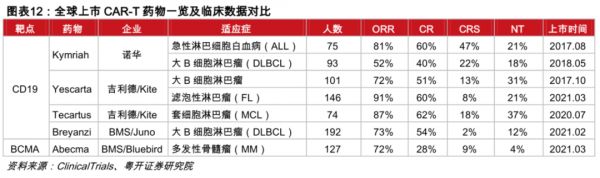
在此之前,世界范围内已有五款CAR-T产品获批上市,分别是2017年获批的瑞士诺华的Kymriah与美国凯特药业的Yescarta,以及凯特药业2020年获批的Tecartus和百时美施贵宝2021年的两款CAR-T:Breyanzi和Abecma。
图片1
而在与之相似的PD-1单抗赛道,如今已掀起国产化浪潮,为肿瘤免疫治疗打开新的想象空间。类似的成功能在CAR-T领域复现吗?
“划时代”背后的隐忧
对于中国细胞治疗产业而言,首款CAR-T疗法的获批上市无疑具有里程碑的意义。然而,这并不意味着国产CAR-T拥有美好的商业化前景,就目前来看仍是隐忧重重,二级市场已经表现出了自己的疑虑。
近期最直观的体现在于,有着高瓴资本入股光环的全球知名CAR-T厂商Lyell和国内实体瘤CAR-T厂商科济药业近期几乎在同一天IPO跌破发行价。
究其原因,CAR-T行业整体还存在很多结构性问题和矛盾。具体可以分成两个层面来看:
靶点“扎堆”与实体瘤“之困”
通过前文不难看出,复星凯特在适应症上无明显差异化优势。核心原因在于,研发方向靶点“扎堆”。
此前,全球获批的五款CAR-T疗法中,除了BMS和蓝鸟生物共同开发的Abecma靶向BCMA,其余四款针对的也都是CD19这一靶点,且有三款都指向大B细胞淋巴瘤这一适应症。
如今,CD19仍是众多CAR-T疗法公司的“心头好”,扎堆现象严重。
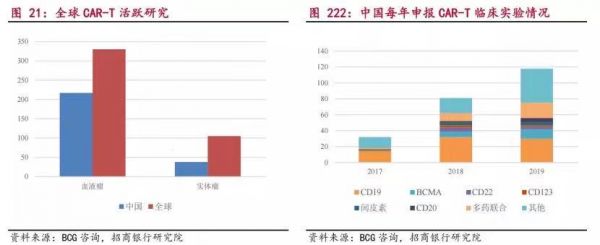
新进的报道指出,全球以CD19为靶点的CAR-T临床,占比已上升到53%;中国357项的CAR-T临床中,涉及CD19靶点的项目就高达175项。
图片2
值得关注的是,CAR-T领域研究目前仍被困于实体瘤迟迟无法突破的难题,一群跟风者纷纷纷纷选择了“Easy模式”的血液瘤。
而实体瘤和血液瘤的患者数量差距,却是云泥之别,若仅面向血液瘤,那细胞疗法的市场空间势必受限。
据悉,血液肿瘤(非实体瘤)仅仅是众多癌症中较小的一部分,最新的全球癌症数据指出:约90%的癌症发病率都是由实体瘤引起。但关于实体瘤的细胞治疗临床试验却很少——2019年发表在Nature Reviews Drug Discovery的数据,自1993年开始的所有细胞治疗试验中,只有一半是针对实体瘤(1203项中有596项)。
换言之,目前主要的CAR-T管线仍在不到10%的癌症市场上打转。相较之下,近十年前,各家药企在PD-1上已针对十几个瘤种铺开上百项临床实验、差异化竞争、扩展更多市场。
究其原因,主要在于实体瘤的细胞疗法存在不少难点,如不同类型实体瘤的异质性大、缺乏独特的肿瘤相关抗原作为CAR-T靶点、T细胞无法有效归巢到肿瘤部位、CAR-T细胞持续性不够以及肿瘤内复杂的微环境对免疫有抑制作用。
成本!绕不开的难题
从已获批上市的5款CAR-T产品来看,定价均在百万之间,这对于绝大多数普通中国家庭来说的确是一笔沉重的负担。
消息指出,复星凯特CAR-T产品的定价大约100万元,为美国价格的一半。如此高昂的价格,公立医院的医生是否倾向将该种疗法推荐给二线及以上患者使用还是一个未知数,如果病人用药后并未治愈,对自身声誉也会有影响。
除市场空间受限外,因为高昂的研发和制备成本,CAR-T疗法势必有高昂的价格,这主要源于其自身的局限性。
简单来说,目前CAR-T药物的制备过程包括:在医院端对患者进行白细胞单采——血样送至GMP生产基地分离出单个核细胞——运用基因工程技术给其中的T细胞导入嵌合抗原受体基因(使其可以特异性识别和杀伤癌细胞)——经体外扩增培养——检验合格放行后,低温送回至治疗中心——回输患者体内完成治疗。
目前已获批或处于临床后期的CAR-T产品主要是用患者自体细胞,生物制造工艺是产业瓶颈,由于一个生产批次仅能用于单一患者的自身治疗,加上流程长且复杂,大约会消耗2-4周不等(Yescarta 平均约17天、Kymriah22天)。
这也意味着,CAR-T的生产更像实验室而非传统工业流水线生产,其GMP验证十分困难,这使得CAR-T生产的刚性成本高居不下,其中生产材料以及QAQC费用占比极高。
与之截然相反的,PD-1的生产是一个标准化的流程,原则上只要产量越大,规模效应越明显,PD-1的成产成本理论上可以无限接近不锈钢反应罐加物料的成本。
同时,由于CAR-T研发过于扎堆,未来会出现过多的药品追逐过少的病人的现象,使得很难产生一家企业具备足够的规模优势从而降低成本。
不过,已经有国产CAR-T企业正在试图降低成本。
今年3月4日,南京传奇生物高级总监蒋忻坡博士提到,原材料要国产化,慢病毒和磁珠都要国产化。“生产慢病毒的技术如果突破使用悬浮细胞,那么价格就会降下来”。但目前来说,这一想法还未能落地。
当然,行业发展仍在早期,对于任何有机会治愈癌症的方法,我们都要给一定时间和宽容。
如何挖到产业发展的金矿?
商业世界始终是残酷的,众多CAR-T疗法挖矿者,挖到金子并成功致富的显然是少数。
据悉,在复星凯特之后,药明巨诺的CAR-T产品也会顶着“优先审评+突破性疗法”的资格紧随其后,即将成为第二家上市产品。另外,有专家预测,为了不让中国CAR-T市场形成“一家独大”的垄断局面,药监部门或许会谨慎地再准入两三家企业,最多不会超过五到七家。
这意味着众多无法拿到“入场券”的中小型公司面临被淘汰,或者不得不调转船头:研发异体细胞CAR-T,或指向实体瘤,或是覆盖更多的靶点。
异体CAR-T疗法
为了摆脱依赖,异体CAR-T成为了行业为之努力的方向,亦即通用型CAR-T疗法。
通用型CAR-T疗法又被称为“现货”(off-the-shelf),是从健康的捐赠者那里收集T细胞或从iPSC中衍生的T细胞,经过工程化设计表达CAR,以识别和摧毁癌细胞。该技术的出现使得工程化T细胞的生产成本有望大幅降低,这为CAR-T疗法的大规模临床应用提供了可能性。同时,患者的治疗流程也将更为简便,加上经济性的优势,有助于提高患者的可及性。
目前,法国Cellectis公司在通用型CAR-T的开发上走在了前列。两名分别为11个月、16个月的儿童白血病患者在接受治疗后,仅发生轻度排斥反应,最终持续缓解时间分别达到了18和12个月。今年3月份,Cellectis公司的通用型CAR-T疗法UCART123获得了美国FDA的批准进入临床试验,预示着异体CAR-T技术临床应用的可能。
国内目前也有不少细胞治疗公司在布局通用型CAR-T疗法,例如亘喜生物、邦耀生物、北恒生物、隆耀生物、克睿基因、茂行生物、森朗生物等。此外,值得一提的是,复星凯特创始人、原公司总裁王立群博士今年低调离职复星凯特,创立新公司“星奕昂”布局“现货”CAR-NK细胞疗法。
不过,通用型CAR-T细胞也并非完美无缺陷,比如:1)供体隐匿性感染的安全问题;2)GVHD或者GVD的产生机制复杂,一或者两个基因的敲出并不能完全消除这种双向排斥作用;3)uCAR-T细胞库的数量、复苏和代次问题,对临床应用和治疗效果会有一定的影响。4)基因编辑时的“脱靶”效应可能引起的一系列潜在安全性问题。这些仍是目前行业需要解决的。
开发新靶点或多靶点
“(细胞治疗)光靠一个靶点很难达到很好的疗效,做抗体的人要做双抗、三抗、四抗,也是想覆盖更多的靶点。”王立群此前也曾在同写意组织的相关讨论中表示。通俗地讲,目前大多数CAR-T疗法是一个靶点,就像用一只手去抓球极易脱手,而双靶点就相当于两只手去抓球,成功率大大增加。
普瑞金联合创始人张继帅认为,“目前免疫细胞药物在血液系统肿瘤中除了CD19和BCMA,还有很多可选的靶点”,例如PD22、CD5、CD7、CD30,它们能解决血液系统肿瘤里面的未被满足的临床需求和其他问题。
截至目前,针对双靶点CAR-T产品,行业也已有不少实际案例。
近日,西比曼生物研发的新型CD19/CD20双靶点CAR-T细胞产品——C-CAR039(针对滤泡性淋巴瘤的治疗)已被FDA授予了孤儿药资格认定。
2021年5月19日,驯鹿医疗宣布其自主研发的全人源抗CD19-CD22自体T细胞注射液的临床试验申请已获得NMPA受理,适应症为阳性的复发/难治性急性B淋巴细胞白血病(B-ALL)。
去年10月,恒润达生双靶点CAR-T细胞候选产品抗人CD19-CD22 T细胞注射液的IND获受理,成为国内首个提交相关申请的双靶点CAR-T候选药物,拟用于治疗复发/难治B细胞急性淋巴细胞白血病。
此外,国内在此领域有布局的还有森朗生物、重庆精准生物、驯鹿医疗、亘喜生物等企业。
指向实体瘤
如前文所言,全球90%的癌症患者为实体瘤,和血液瘤市场完全不在一个量级上。正心谷资本方面分析,这是CAR-T最大的市场机会......肝癌、肺癌、乳腺癌、结直肠癌、胃癌等大癌种,引来了无数闯关者。
举例来看,科济药业的一款靶向CLDN18.2的CAR-T产品,目标是胃癌和胰腺癌。CLDN18.2是一种高度选择性的细胞谱系标记物,在70%至80%胃癌患者及约60%胰腺癌患者的癌组织中普遍表达。在该领域,传奇生物、凯地生物等也有产品在研。
永泰生物目前也将研发重点放在了治疗实体瘤的研发方面,目前已布局了扩增活化的淋巴细胞EAL®(非基因改造技术路线),适应症包括肝癌、胃癌、肺癌等,其中针对肝癌(预防肝癌术后复发)的研发目前已经处于临床II期试验。
寻找产业链上下游的机会
当然,无论行业有多“内卷”,新的研发方向有多难,国产CAR-T疗法的获批于企业、于患者而言,都是福音;与此同时,细胞疗法商业化时代到来,也孕育着产业链上下游相应的爆发式增长机会。毕竟,未来产品降价是一定的、外包也是一定的。
典型受到利好的就有细胞治疗CDMO行业。一个核心逻辑在于,生产工艺的复杂性决定了其技术壁垒,药企外包意愿强烈,因而未来细胞治疗 CDMO 的市场有望快速增长。
根据 Frost & Sullivan 的估测,全球基因细胞治疗的外包市场有望从2017 年的12亿美元增长至2022年的36亿美元,年均复合增长25%,远快于行业平均增速。
目前CAR-T制备最核心的成本主要在于材料&器材、综合运营成本部分,其中就包括科研试剂设备及耗材和病毒载体的制备供应。
就CAR-T产品的特殊需要来看,其过程相对繁琐且质控环节多,包括:单采白细胞及细胞清晰,富集T细胞并激活,基因传递/转染,细胞培养,冷冻及运输,最终输回患者体内。这需用到血细胞分离淘洗机等多种设备、试剂及耗材。
目前,这些关键设备及试剂供应商多来自跨国公司,如GE、德国美天旎、赛默飞世尔等。尽管国内也有相应设备、试剂生产商,其价格有些仅为进口产品的1/10,但要保证制备出的CAR-T细胞安全且有效,国内研发企业大多会选择采购进口产品,这构成了CAR-T细胞生产过程很大的一部分成本。
另外,递送基因的病毒载体则是最终获得CAR-T产品的关键组成部分,CAR-T的规模化生产,某种意义上可以说是其应用的病毒载体的规模化生产。
在这方面,药企只有两条路可以选择,要么自建生产体系,要么外包给CDMO公司。显然,大多数企业会选择后者。毕竟,CAR-T细胞的生物制造工艺是其产业瓶颈,自动化和标准化处理将是该过程的高壁垒技术。
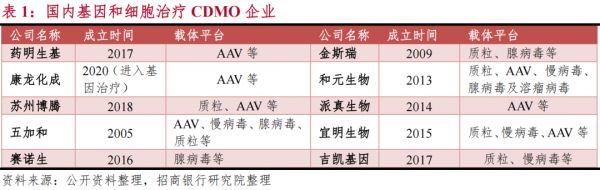
而形成规模化的CDMO企业无疑拥有更多优势,最核心的是可以通过自动化生产、标准化制造慢病毒、质粒等方式降低成本。目前,已有不少企业看到了其中的机会,譬如金斯瑞、和元生物、派真生物等。
就在不久前,和元生物申报科创板也已获受理,生物细胞治疗CDMO也迎来了一个新的发展阶段。
图片3
不论如何,不同于一经上市便能迅速实现商业化的传统化药,细胞治疗太特殊了,药企若想胜出,不仅要争夺药物研发的领先优势,更要设法解决后续商业化生产的各个环节中要面临的问题等,而这也给CDMO赛道带来了爆发式增长的机会。
相关推荐
知料 | 划时代的细胞疗法上市,还隐藏着爆发力极强的行业机会
潮科技 | 细胞疗法行业探索:CAPRI细胞疗法
细胞疗法领头羊,永泰生物未盈利欲上市
细胞免疫疗法的三重罗生门
知料 | 苹果的颜色简史:从性冷淡到五彩斑斓
站在基因疗法的风口上
把25岁的细胞储存起来,未来用于长命百岁?
正在崛起的非洲,隐藏着这5个躺赚的机会
瞄准细胞免疫疗法,「华夏英泰」完成4500万元A轮融资
36氪首发 | 专注新型实体瘤细胞疗法,「君赛生物」获数千万元Pre-A轮融资
网址: 知料 | 划时代的细胞疗法上市,还隐藏着爆发力极强的行业机会 http://m.xishuta.com/zhidaoview20480.html