50余款抗癌药物获FDA审批,“救命药”何时能不再遥不可及?| 2020盘点
在今年2月3日,抗癌电影《送你一朵小红花》献唱的歌手赵英俊因肝癌去世,时年43 岁。
2月4日是第21个“世界癌症日”,今年的主题是“关爱患者,共同抗癌”。据世卫组织的数据显示,全球五分之一的人会在一生中罹患癌症,2020年全球确诊的癌症患者数量达到1930万,死于癌症的人数增加到1000万。
近年来,姚贝娜、魏则西、李咏、贺一航、博斯曼......等等名人因癌离世,令人惋惜。由于现在人们普遍缺乏锻炼、生活不规律以及精神压力大,癌症也有了年轻化的趋势,从2000到2013年,20岁到39岁的年轻人中肿瘤发病率增长了近80%。面对癌症,我们需要积极正确地面对疾病,早预防、早发现、早治疗。除了保持健康生活习惯、开展防癌筛查外,抗癌药物也是抵抗癌症的重要手段之一。
1、抗癌药简介:靶向抗肿瘤药物是近十几年间成为抗肿瘤新药的主流
抗癌药物包括化疗药物、靶向药物、生物药物、中药等,用于治疗癌症或癌症相关症状。根据其作用原理与性质,抗癌药物大致可被分为细胞毒类药物、激素类药物、生物反应调节剂、单克隆抗体药物和其他类药物。细胞毒类药物可以影响核酸(DNA/RNA)的合成与转录或细胞分裂中各类蛋白的合成,从而抑制肿瘤生长。激素类抗肿瘤药则是通过特异性与激素受体结合而发挥作用。生物反应调节剂包括干扰素、白细胞介素-2等,通过机体免疫功能抑制肿瘤。单克隆抗体则能够与抗原特异性结合,被形象地被称为“生物导弹”。
靶向抗肿瘤药物是指利用肿瘤细胞的特异性结构分子作为靶点,使用某些能与靶分子特异性结合的抗体进行导向治疗。由于其特异性高、毒副作用较小、疗效显著,在近十几年间成为抗肿瘤新药的主流。
2、不容忽视的中美技术差距,好消息是抗癌药逐渐纳入医保,成为患者买得起“救命药”
在2020年的春节前,国家药监局批准了靶向新药赫赛莱(通用名:恩美曲妥珠单抗)上市,这是中国首个获批的抗体偶联药物(Antibody-drug Conjugate,缩写为ADC),成为国内靶向抗肿瘤药领域的里程碑事件。ADC有两个核心的功能组成部分:第一是抗体(导弹体),第二是强化疗药(核弹头)。这两者通过特殊的连接物结合到一起,兼具了抗体药物的靶向性和化疗药的强大杀伤力。随着ADC技术不断成熟,ADC药物迎来黄金时代,或将成为下一个抗肿瘤新药的潮流。
目前,国内的抗癌药领域与国外相比依然有很大的差距。
国外抗癌药研发、上市的速度更快。例如2018年,PD-1抗体才于国内上市,比美国晚了整整4年;然而同时美国第二代PD-1抗体已开始临床试验。而在2020年,FDA审批通过了50余项新抗癌药物,数量远超国内水平。 抗癌药物研发差距很大。美国上市药企研发投入远超国内;在已有经验与研究结果的基础上,发达国家具有更强的研发水平,对于抗癌新药的研发频频取得突破。而之前国内市面上主要的生物药许多是在国际抗癌药专利过期后仿制的。不过,好消息是,在国内,抗癌药逐渐纳入医保,让患者买得起“救命药”。
《我不是药神》戳痛了无数人的心。大部分的抗癌特效药由于其价格昂贵,普通家庭难以承受。2018年7月,国家医保局已开展新一轮抗癌药医保谈判。直到2020年12月,通过国家医保局3轮药品谈判准入工作,医保药品目录内癌症用药的保障水平明显提升。
经过医保谈判后,2020年12月28日,国家医保局、人社部公布《国家基本医疗保险、工伤保险和生育保险药品目录(2020年)》(以下简称医保目录)。2018年国家医保局组织开展了抗癌药专项准入谈判,最终17种药品谈判成功纳入目录,并于2020年底协议到期;14种独家药品按规则进行了续约或再次谈判,平均降幅为14.95%,个别一线抗癌药降幅超过60%。调整后,目前上市的四种国产PD-1抗癌创新药全部进入医保目录。[1]
3、全球基础科学研究驱动抗击癌症的进展
美国癌症研究协会(AACR)于2020年9月发布了2020年抗癌进展报告(AACR Cancer Progress Report 2020)。AACR的报告指出基础科学研究对理解和治疗包括癌症在内的人类疾病做出了突出的贡献,例如:[2]
对DNA结构的理解为我们理解基因突变铺平了道路,而基因突变是大多数癌症产生的原因; 对正常细胞DNA修复机制的理解带来了FDA批准的治疗乳腺癌、卵巢癌、胰腺癌和前列腺癌的靶向疗法; 几十年来免疫学领域的基础研究奠定了肿瘤免疫学疗法诞生的基础,为癌症治疗带来革命性的改变; 对NTRK基因的基础生物学研究和发现NTRK基因融合促进多种癌症的生长最终带来了FDA批准的“不限癌种”疗法larotrectinib和entrectinib。血液瘤和实体瘤是目前的热门靶点,CD19仍是血液瘤细胞疗法最主要的靶点,自去年以来,靶向B细胞成熟抗原(BCMA)或CD22的疗法数量几乎翻了一番。实体瘤细胞疗法最主要靶向未披露的肿瘤相关抗原(TAA),共有65个活跃的在研项目。此外,TOP10靶点中变化最大的是Glypican 3(GPC3)和前列腺特异性膜抗原(PSMA)。
近日,来自威康桑格研究所、大奥蒙德街医院和公主儿科肿瘤学中心的研究人员发现,所有的神经母细胞瘤都起源于一种称为交感细胞的单一类型的胚胎细胞,这使得它们成为一个极具吸引力的药物靶点,或有助于神经母细胞瘤的治疗。
此外,对于Nectin-4I型膜蛋白等等的多项研究或有助于ADC药物与其他种类抗癌药物的研发。
覆盖多类实体肿瘤,FDA批准近50种新疗法
2020年,FDA共批准了近50种新疗法,覆盖了各类实体肿瘤,为许多癌症患者带来了新的治疗选择与新的希望。[3][4]
非小细胞肺癌
Capmatinib(卡马替尼)
卡马替尼于2020年5月6日被美国FDA批准上市,是FDA批准的针对局部晚期或转移性MET 14跳跃突变的非小细胞肺癌(NSCLC)患者的首款靶向药。它是一种口服的高选择性小分子MET抑制剂,用以治疗携带MET外显子14跳跃突变的转移性非小细胞肺癌(NSCLC)。
Alunbrig(布加替尼)
FDA于2020年2月24日授予布加替尼优先审查指定,用于基因检测ALK阳性的转移性非小细胞肺癌(NSCLC)患者的一线治疗。
selpercatinib(塞尔帕替尼,LOXO-292,Retevmo)
2020年1月30日,FDA授予LOXO-292优先审批。三个月后,这款传奇抗癌药于2020年5月8日加速获批上市,同时也有了自己的大名-Retevmo。Retevmo是首个被批准专门用于治疗携带RET基因变异的癌症患者的精准疗法,其适应症为晚期RET融合阳性非小细胞肺癌、RET突变型甲状腺髓样癌(MTC)和RET融合阳性甲状腺癌的患者。
Pralsetinib(普雷西替尼)
2020年9月5日,全球第二款RET抑制剂Pralsetinib获得FDA批准正式上市,用于经FDA批准的测试RET融合阳性转移性非小细胞肺癌(NSCLC)成人患者的治疗。这是目前唯一一款每日仅需口服一次的RET抑制剂,并且显示出持久的疗效,部分患者得到完全缓解。
小细胞肺癌
阿特朱单抗
2019年3月,美国食品和药物管理局(FDA)批准atezolizumab(阿特朱单抗,Tecentriq)与卡铂和依托泊苷联合用于广泛期小细胞肺癌(ES-SCLC)患者的一线治疗。2020年2月13日,中国国家药品监督管理局正式批准了罗氏旗下重磅肿瘤免疫创新药物atezolizumab联合化疗用于一线治疗广泛期的小细胞肺癌,同时这款药物也有了自己的中国名字-泰圣奇(阿替利珠单抗),这是目前国内第一款也是目前唯一一款联合化疗用于小细胞肺癌一线治疗的药物。
德瓦鲁单抗
阿斯利康(AstraZeneca )宣布美国FDA接受了其免疫疗法Imfinzi(durvalumab,德瓦鲁单抗)的补充生物制剂许可申请(sBLA),并授予该申请优先审评资格。本申请的适应症为先前未接受过治疗的广泛期小细胞肺癌患者。这将成为第二款获批一线治疗小细胞肺癌的PD-L1抑制剂,第一款是罗氏的阿特珠单抗。
乳腺癌
图卡替尼
用于HER2阳性乳腺癌的重磅新药图卡替尼(Tukysa),在2020年8月20日前获批上市。图卡替尼提前四个月被FDA加速批准上市,其用于联合曲妥珠单抗和卡培他滨用于治疗局部晚期无法切除或转移性HER2阳性乳腺癌的患者,包括脑转移瘤患者。
Trodelvy
2020年7月7日,immunomedics宣布开发的抗体偶联药物Trodelvy(sacituzumab govitecan-hziy),在治疗转移性三阴性乳腺癌(mTNBC)患者的确认性3期ASCENT临床试验中达到了无进展生存期(PFS)的主要终点,将患者疾病进展或死亡风险降低59%。早在2020年4月22日,FDA已加速批准Trodelvy上市,Trodelvy成为FDA批准的首个治疗三阴乳腺癌的抗体偶联药物,也是全球首个获批的靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药物。
atezolizumab(阿特珠单抗)
2019年3月8日,全球首款用于治疗乳腺癌的免疫检查点抑制剂-atezolizumab(阿特珠单抗)获批上市。在2020年ESMO大会上,公布了一项最新的临床试验IMpassion031 3期临床数据,结果显示与安慰剂+化疗相比,在nab-紫杉醇(Abraxane)+阿霉素+环磷酰胺化疗方案中添加阿特珠单抗(atezolizumab)可以显着改善2期或3期三阴性乳腺癌(TNBC)患者的病理完全缓解率。
Keytruda
FDA于2020年11月13日批准了加速批准了默沙东(MSD)重磅PD-1抑制剂Keytruda与化疗联用,用于肿瘤表达PD-L1([CPS]≥10,经FDA批准的检测确定)的不可切除局部复发性或转移性三阴性乳腺癌(TNBC)患者,这是Keytruda首次在治疗乳腺癌这一适应症方面获得FDA的批准。
消化系统肿瘤
ripretinib(瑞普替尼)
2020年5月15日,美国FDA宣布,批准蛋白激酶抑制剂Qinlock(ripretinib,瑞普替尼)片剂上市,成为首款专门4线治疗晚期 胃肠道间质瘤(GIST)的创新疗法。此药的适应症为GIST成年患者。
Avapritinib
FDA于2020年1月9日批准Avapritinib 用于患有不可切除或转移性胃肠道间质瘤(GIST)的成年人,该成年人具有血小板衍生的生长因子受体α(PDGFRA)外显子18突变,包括D842V突变。
pemigatinib
2020年4月17日,FDA加速批准Incyte公司Pemazyre(pemigatinib),用于治疗既往接受过治疗的携带成纤维细胞生长因子受体2(FGFR2)融合或重排的局部晚期或转移性胆管癌患者。pemigatinib也成为了全球首个胆管癌靶向药。
Braftovi二药方案
2020年4月8日,辉瑞(Pfizer)公司宣布美国FDA已经批准 Braftovi®(encorafenib,康奈非尼)和Erbitux®(cetuximab,西妥昔单抗)联合用药方案(Braftovi二药方案),用于治疗携带BRAF V600E突变的转移性结直肠癌(mCRC)患者。此次批准使得Braftovi二药方案成为首个获批的携带BRAF基因突变mCRC患者的靶向疗法。
甲状腺癌
Gavreto
2020年12月2日,FDA宣布已经加速批准普雷西替尼(Pralsetinib,Gavreto)的扩展适应症,用于治疗RET突变阳性的晚期或转移性甲状腺髓样癌成年及12岁以上儿童患者,和RET融合突变阳性、需要进行全身治疗联合放射性碘治疗的难治性晚期或转移性甲状腺癌患者。这是继非小细胞肺癌之后普雷西替尼的第二项适应症。
NMPA批准6款国产肿瘤创新药上市
突如其来的新冠疫情并没有打乱肿瘤新药的研发、临床与上市。2020年,多款肿瘤药向中国国家药监局(NMPA)提交上市申请,据不完全统计,共有6款成功得到审批。[5]
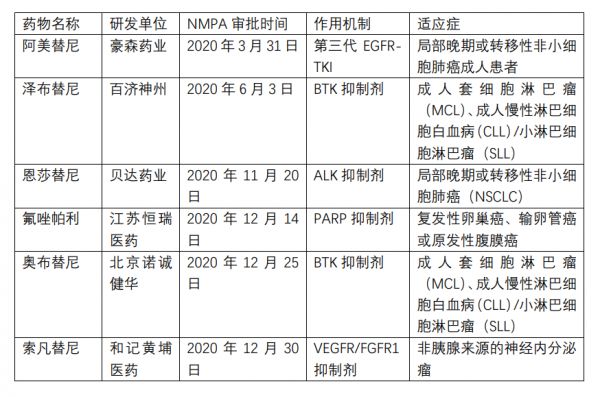
2020年部分得到NMPA审批的肿瘤药物
[1]2020版国家医保目录发布 四种国产抗癌药品进入医保目录
[2]好文收藏!美国癌症研究协会发布2020年抗癌进展报告
[3]2021,晚期肿瘤患者一定要知道的五大抗癌领域新进展
[4]2020年世界新研制成功的抗癌药有哪些?
[5]这些抗肿瘤新药 治愈了2020 也将惊艳2021!
相关推荐
50余款抗癌药物获FDA审批,“救命药”何时能不再遥不可及?| 2020盘点
本土新药实现出海“零突破”:首款自主研发抗癌新药FDA获批
最前线 | 百济神州又下一城,抗癌药物 PD-1 在国内获批上市
最前线 | 提前4个月,“泽布替尼”成中国首款获FDA批准抗癌药
两千亿孤儿药市场,谁主沉浮?
医疗健康行业周报 | 康立明生物完成6亿元C轮融资;荣昌生物ADC药物获FDA突破性疗法认定;2019年中国医疗器械进出口总额554.87亿美元
研发抗癌创新药物,「Radix Therapeutics」发表“血管去转化治疗”新方案
新一代的“抗癌利器”,「肿瘤电场疗法」Optune正式落地香港
医疗健康行业周报 |百奥赛图获9.7亿元D+轮融资;药监局发布《高通量测序仪标准》;君实生物单抗药获FDA孤儿药认定
成立十年仍在亏损,「百济神州」拟上市科创板打开局面
网址: 50余款抗癌药物获FDA审批,“救命药”何时能不再遥不可及?| 2020盘点 http://m.xishuta.com/newsview38340.html