谁会成为新冠杀手?
编者按:本文来自微信公众号“Dots机构社区”(ID:DotsCommunity),作者:Dots机构社区,36氪经授权发布。
本文来自Dots机构投资者社区,作者:Dots机构投资者社区成员、银石投资基金经理曹琰,经授权发布。
今年年初,作为有焦虑症的我,就早早开始担心新冠像SARS那样在中国流行,在一月下旬就开始担心,中国虽然控制住了新冠,但是新冠再由别国传回。目前看来都猜中了,作为一个非常狡猾的病毒,她有潜伏期长,症状多样化,无症状感染者也能够传染他人,且比例不是很低的特点,比起烈性病毒SARS,她的温柔是致命的。
由于这些特点,让隔离和防控变的异常艰难。在人群中,我们无法辨别谁是感染者,谁不是。这样的情况下,精准隔离几乎成为不可能。因此,多数国家走向了严格的隔离之路,这种隔离以牺牲消费和经济停摆为代价,但是经济停摆和停止消费可能对一国的伤害比疫情本身更为严重,大量劳动力失业,服务业企业倒闭,员工降薪等等。在全球大流行的情况下,任何一国的严格隔离都将难以独善其身。
于是,从小分子到抗体药,全球各大药企和科研机构开始了“神药”的追逐之旅。目前,寻找神药的思路主要分为三个:
第一个思路是,从既有的老药中寻找到有效的抗病毒药物或者组合,能够有效帮助人体清除病毒。
比如,吉列德的瑞德西韦在两个月以前被一篇24小时内“治愈”美国重症患者的文章带上了神药的皇冠,理论上看瑞德西韦是非常有希望的,他主要通过阻止病毒在细胞内进行RNA的复制产生效果,因为无论病毒如何变异启动RNA复制的部分是不会变的,未来无论如何发展,如果瑞德西韦被证明有效他的持续性就会不错,应该是广谱的抗新冠药。
但是新冠本身的自愈率就在80%以上,如何设计临床才是能否辨别药物有效与否的关键。目前瑞德西韦最大的临床也不过千人,最后的结果还没出来,而其副作用是否能够让它使用在轻症患者中也是一个问题。
而另外一个日本“神药”法匹拉韦,由海正药业和FUJI Film合作研发,2014年在日本作为难治性或耐药流感的治疗药物上市,2月也在中国深圳市三医院展开了80人左右的临床研究,实验结果表明服药后两天内退热效率达到72%,3天内肺部影像学好转率38%,6天内肺部影像学好转率70%。
在法匹拉韦治疗组的病毒清除中位数时间更短为4天(2.5-9天),对照组为11天(8-13天),两组具有显著性差异。而其他的一些组合,比如羟氯喹+阿奇霉素,也是近几周被发现对于新冠有一定治疗效果,羟氯喹主要通过调节人体免疫,抑制过度的免疫反应来防止新冠轻症转化为重症。
第二个思路是,既然有80%是轻症病人,都可以自愈,那么只要能够防止轻症转化为重症就可以。
而重症主要是由于细胞因子风暴造成的,也就是人体自身过度的免疫反应。治疗人体过度免疫反应的靶点和药有很多,比如我们熟知的TNFα(阿达木单抗(艾伯维,海正,百奥泰,信达)等),IL-6(托珠单抗(罗氏,百奥泰)等), 还有中国抗体做的CD22等,都可以抑制人体的过度免疫反应。
但是控制/防止细胞因子风暴需要多少剂量,多大浓度的用药,以及大剂量使用这类单抗是否有问题都还不得而知。另外,舒泰神的BDB-001针对C5a的单抗也可以对任何原因引起的细胞因子风暴进行治疗,目前也进入了Ib临床试验,由李兰娟院士担任PI。

第三个思路,我认为是最有希望短期成药的,就是寻找新冠病毒大分子抗体疗法。
2020年3月11日,荷兰Utrecht University的Berend Jan Bosch教授团队在BioRxiv学术期刊发表文章,首次报道了能够同时中和SARS-Cov和SARS-Cov-2的全人源交叉中和单抗47D11,该单抗靶向S蛋白受体集合区域中的某个保守单位,从而改变了宿主细胞的感染进程,帮助清除病毒,保护未被感染的宿主细胞,具有预防和治疗COVID-19的潜力。
再生元(REGN)曾经与HHS(美国卫生和公共服务部)合作,开发治疗埃博拉病毒的抗体疗法REGN-EB3,这一疗法在2019年治疗埃博拉病毒患者的PALM临床实验中表现出了积极疗效,相较于mAb114的 11%的死亡率,ZMapp 24%的死亡率,和瑞德西韦33%的死亡率,这一疗法将埃博拉的死亡率降低到了6%。
mAb114和ZMapp也都是单克隆抗体,其中mAb114来自于在幸存者在感染埃博拉病毒11年以后仍然保留的抗体,而ZMapp则来自于埃博拉病毒实验动物体内产生的抗体。我们不得不说,再生元在对抗埃博拉病毒上,为人类做出了伟大的贡献,而对于同样是冠状,且同样高度糖基化的新冠病毒,我们认为再生元也仍然有可能做出媲美REGN-EB3的抗体。
再生元的优势来源于其独有的VelociSuite技术,包括其Veloclmmune技术平台,这一平台使用独有的基因工程改造小鼠模型,使它具有人源化免疫系统,用病毒的一部分或者整个病毒处理这些小鼠,能够促进迅速发现具有前景的候选抗体,并对他们进行临床前研究和开发。而他的快速开发能力已经在埃博拉病毒爆发时得到了验证。
而康复病人的血清对于治疗新冠病毒也有疗效,也是中和抗体存在的证据。目前,我们的君实生物(1877.HK)也开始与中科院微生物所合作开始研发中和抗体药物。一旦找到有效的广谱中和抗体,那么在生产和临床上,抗体药物将有可能快于疫苗。但是没有再生元的人源化小鼠平台,寻找合适的广谱中和抗体也并非能够快速完成的工作。
但即使有新药出来,只要无法形成群体免疫,仍然无法阻止大规模感染。彻底恢复经济,根除病毒威胁的方法还是要靠疫苗,而不是特效药。那么,疫苗研发需要多长时间,研发中会遇到什么困难,如何应对变异后的病毒将是我们的主要课题。
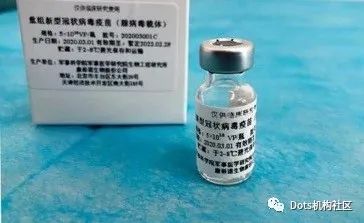
我们先来看看新冠病毒长啥样,有助于我们理解疫苗研发的难点。
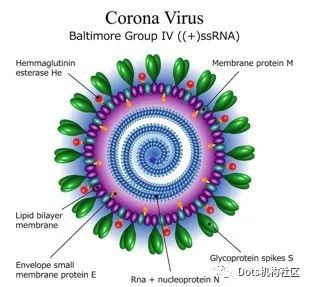
新冠病毒是个球形的,乍看之下还有点可爱,但是正是这个可爱的球给疫苗带来了很多研发难点。首先,因为他是RNA病毒,是变异王中王,因此疫苗研发需要找到这个病毒的保守部分,即无论如何变异,如果某一段RNA变异了,病毒就无法和宿主细胞结合,那么这段RNA表达出的抗原就是可以用来做疫苗的。
其次,这个病毒是个球形,结构特别庞大,它表面蛋白的糖基化位点特别多,有66个位点。其中我们看到上面绿色的S蛋白上也都是糖基化的。糖基化让疫苗研发存在一定难度,比如HIV疫苗。但是也并不是不能解决,同样存在高度糖基化的冠状病毒,例如埃博拉病毒就有效果不错的疫苗快要上市了。而且,相较1976年的埃博拉病相较于2014年的埃博拉病毒只变异了3%。所以不要太过担心疫苗的变异,我们很有可能像应对流感那样去应对冠状病毒。
目前新冠疫苗研发主要分为:mRNA疫苗,灭活/减活疫苗,腺病毒载体疫苗等。

一般来说,从疫苗的研发到最后上市需要经过一系列的流程,新疫苗的研发一般情况下至少需要5年。主要包含了一下步骤:
进行体外实验,疫苗设计(时间不定,mRNA疫苗设计最快,其次是重组载体疫苗,最后是减活疫苗)
动物实验(正常大大小小一共要30多个动物实验,包括小鼠实验,灵长类动物实验等等,一般抓猴子就要好长时间)
一期临床(主要验证安全性,也有可能考虑剂量和接种方式,一般小几十人)
二期临床(主要研究剂量和接种方式,检测抗体浓度等等,如果一期做的多,二期可能跳过,一般要500-1000)
三期临床(主要在自然状态下进行双盲实验,看注射过疫苗的人群在自然状态下的感染率,一般根据流行程度需要1000-10000不等)
但是在加快审批和尽量节约能够节省的步骤的情况下,有些种类的疫苗是可以加快的。以目前我们在研的这几种疫苗来看,减活疫苗的临床前研究应该需要的时间最长,因为减活疫苗的第一步就是需要筛选出合适的弱毒株,如果是流感这样每年都流行的病毒,减活毒株可能很容易能够筛选出,但是面对新冠这样第一次流行的病毒筛选出免疫原性和安全性俱佳的毒株试错的过程可能会很长。
虽然不知道为什么有公司选择了去做减活疫苗这条路径,但是常理上说,选择合适的毒株确实是一个漫长试错的过程,要么在已有的毒株里选择合适的,要么通过和近似种类的弱毒株杂交去选择合适的弱毒株,总的来说都会比较慢,至少大几个月是需要的。
mRNA疫苗的临床前研究和设计应该是最快的,科学家可以根据经验节选多段可能表达冠状病毒保守区域的mRNA进行组合。但每一家运用脂质体(博瑞医药有生产)运送mRNA的平台技术比较不同。是否能够让mRNA在人体内能够顺利合成病毒的特异性抗原,激发人体的免疫反应还有待观察。
因为mRNA本身就很容易被分解,甚至人的手上都带着分解mRNA的酶,虽然理论上可行,但是人体试验未必work。所以,我们认为,mRNA也许能在临床前跳过很多步骤,包括灵长类动物实验,但是人体试验一定是不能省时间的。因为mRNA最不确定的就在于人体试验,我们不知道mRNA在人体内是否能被顺利翻译成蛋白质,也无法确定翻译出来的蛋白质是否能够激起足够的免疫反应。所以2期和3期的时间一定是不快的。
基因重组的腺病毒载体疫苗,如果有成熟的平台,那么从设计上时间也可以非常快。但是同样人体试验,特别是2期和3期就非常重要。这还取决于你用了什么腺病毒平台,比如说康希诺使用的Ad5平台(删除了复制基因),的一个重要问题就是,Ad5在人群中已经普遍有中和抗体,特别是在东南亚人群中,据有论文提及东南亚人群中90%有ad5的中和抗体,而另一项在广州的研究提示人群中有55%左右的人有较高的ad5中和抗体。强生用的ad26则人群中有人感染的比例不是特别高。所以我们需要观察2期的剂量研究,多高才能激发足够的抗体浓度,更需要观察3期对自然人群是否具有保护力。
我们目前还不知道康希诺会如何解决这个问题,但是这个问题并不是不能解决。因为腺病毒载体经过改造已经基本是一个空壳,而在过去的研究中发现,Ad5载体的应用受限于被野生型Ad5感染后人体内已经存在的较高滴度的中和抗体水平。尽管病毒外壳上不同的衣壳蛋白均能诱导宿主产生抗体,但实验显示 Ad5特异的中和抗体主要针对的是病毒六邻体蛋白(Sumida et al.,2005)。另外,腺病毒的免疫是血清型特异的,这就提示我们可以使用在人体内感染极低的腺病毒六邻体来替换 Ad5,从而可以逃避Ad5的预存免疫。
如果不用这个方法来做,那么也可以通过其他方法来解决,比如让人们接受皮下注射的疫苗,因为皮下Ad5中和抗体的密度不高,可能被中和的概率较低。
但是我相信,在用Ad5做腺病毒载体疫苗的时候,陈薇院士比我们这种半路出家的人要清楚很多,应该如何避免这个问题,我觉得也不用太操心。在一期的临床实验中,我们也看到实验人员被要求在14天,28天,3个月,6个月检测S蛋白特异性抗体以及抗Ad5中和抗体。在一期临床结束后,我们就可以大概了解是不是多数人都会有抗Ad5中和抗体。
总的来说,我们对明年上半年就有可用的疫苗还是抱有很大希望,特别是腺病毒载体疫苗,希望我们能从1期的实验中得到好消息,如果只有小部分人有Ad5的中和抗体,而且可以通过皮下注射,或者提高剂量来解决,那么我们大可以不必这么担心,拭目以待。
相关推荐
谁会成为新冠杀手?
少数派的未来猜想 | 谁会取代手机?可穿戴设备或是下一个“杀手应用”
B站和知乎,谁会成为社交媒体的新网红?| 猛侃专栏
运营商无法让5G直播成为杀手级应用
资本疯狂涌入医疗市场,BATJ谁会成为风口上的那只猪?
过去十年,移动互联网都诞生了哪些杀手级应用?
比尔·盖茨:新冠肺炎可能成为百年不遇的大流行病
非洲新冠病例一周激增47%,“火药桶”要爆发了?
AR领域的杀手级设备已经诞生?苹果认为就是智能手机
淘宝特价版猛攻下沉市场,谁会成为绊脚石?
网址: 谁会成为新冠杀手? http://m.xishuta.com/zhidaoview8399.html