36氪专访 | 手握基因编辑工具IP,辉大基因如何加速基因治疗管线研发?
在生命科技领域,基因编辑工具CRISPR-Cas系统已为人熟知,被称为“基因魔剪”,能够靶向特定基因进行DNA/RNA序列修改。当前,在美国已经有多家基因编辑工具公司上市,而技术底层IP主要被欧美企业垄断,原则上使用CRISPR-Cas系统的基因治疗、基因检测企业,都需获得相关海外企业的授权。
据了解,在商业化过程中,药企获得基因编辑相关专利许可,需支付数百到数千万美元的首付款,后续的里程碑付费合计可能高达上亿元。2021年10月,美国干细胞治疗公司Sana Biotechnology与华裔教授刘如谦、张锋等创建的基因编辑公司Beam Therapeutics达成合作,Sana向Beam支付5000万美元预付款,以获得CRISPR-Cas12b核酸酶系统的非独家商业权利。
中国药企在产品商业化、特别在国际市场的销售过程中,也需向海外基因编辑工具企业支付相应的专利许可费。因此,这一领域核心技术的自主可控,研发更安全、有效的基因编辑工具,成为中国科学家发力的方向之一。
辉大基因创始人杨辉博士(国内知名科研机构神经所高级研究员),2013年起即开始使用CRISPR-Cas工具研究基因编辑动物,回国之后的近10年间,团队聚焦在基因编辑工具开发和基因治疗。2018年,杨辉博士、姚璇博士等创建了辉大基因,2019年团队发现了Cas13蛋白的两个家族Cas13X、Cas13Y,是继Cas13a/b/d之后新的RNA编辑工具。
2022年1月,辉大基因CRISPR-Cas13X、Cas13Y的底层技术获美国专利局授予专利;并与国内某细胞治疗企业达成首次“对外普通技术许可协议”;5月辉大基因完成数亿元C轮融资。36氪专访了辉大基因联合创始人、CEO姚璇博士,讲述公司基因编辑工具的特点,及基因治疗药物管线研发的新进展。
研发基因编辑工具,成为“桌面上的玩家”
“过去10年间,我们团队基本把CRISPR-Cas所有的亚族、亚型以及优化方法都进行了尝试;在这基础上,建立了系统的方法论,包括如何发现新的CRISPR-Cas蛋白,如何针对脱靶、编辑效率、PAM(原型间隔区相邻基序)识别等进行改进,中间积累了很多know-how的细节。”姚璇博士总结道,在后期验证过程中,团队也开发了一套检测系统,以在众多Cas中定位高活性编辑蛋白。
那么,相比于同类RNA编辑工具,CRISPR-Cas13X、Y有哪些特性?
“Cas13X是目前最小的Cas13蛋白;在编辑效率上,Cas13X/Y在体外试验的敲减活性接近100%,体内的编辑效率约95%。除了可以做RNA的knock down,还可以通过对Cas13X/Y进行改造、与脱氨酶结合进而实现RNA单碱基编辑,比如在杜氏肌营养不良症(DMD)的基因治疗中,目前辉大的单碱基编辑工具基本可实现接近80%的RNA单碱基编辑效率。”
另外,由于Cas13蛋白普遍存在旁切活性问题,也就是基因编辑中的“脱靶效应”,已有研究证明Cas13d可能造成体外细胞凋亡、Cas13d转基因小鼠存活率显著降低。针对这一问题,辉大研发团队对Cas13d及自研的Cas13X.1进行改造,全转录RNA测序、体外细胞实验、以及转基因小鼠观察等试验结果显示,改造后的高保真版Cas13d以及Cas13X.1,基本检测不到旁切活性,且在细胞和动物中显示出高安全性。
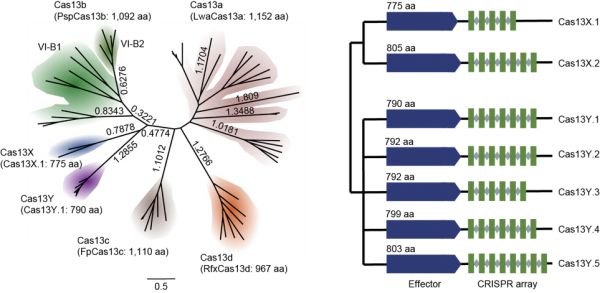
æCas13X/Y解析图
除了RNA编辑工具,辉大集团子品牌“HuiEdit”开发了DNA编辑器Cas12Max,与多个DNA编辑器相比,Cas12Max蛋白体积更小,适用于基于AAV(腺相关病毒)载体递送的体内基因编辑。
“将Cas9系统应用在体内基因治疗,可能需要两个AAV载体进行递送。Cas12Max体积跟SaCas9相当,比spCas9小1kb(Kilobase,即千碱基),只需要一个AAV载体包装即可,这对于CMC生产工艺、AAV递送以及体内基因治疗的应用都有优势,”姚璇博士对36氪表示。
Cas12Max系统,当前已经应用到体内基因治疗的研发中,包括肝脏、神经和肌肉领域在内的多种适应症。在未来的商业规划中,一方面公司会向细胞治疗、植物育种等企业License-out基因编辑工具;同时自研基因治疗管线,在进入临床二三期或商业化进程中,也将与跨国药企合作共同开发。
两个基因治疗管线将IND
目前辉大基因的研发管线,主要集中在神经、眼科、肌肉、听力四类,其中眼科的两个基因治疗管线已经进入IND申报阶段,针对适应症分别是先天性黑蒙症2型(LCA2)、老年湿性黄斑病变(wet AMD)。
在基因治疗的管线选择上,药企多从罕见病着手,一方面是由于超过80%的罕见病是单基因遗传病,基因治疗可纠正潜在遗传缺陷,是一种有效的治疗手段;另外当前不少致死、致残的罕见病,临床上缺少治疗药物,在这种情况下,患者、监管等层面都更有动力尝试如基因治疗这类全新的疗法。
先天性黑蒙症是一种罕见遗传性视网膜病变,会导致婴幼儿先天性视盲,在中国有数千名患者。目前,能够治疗该疾病的药物仅有AAV递送RPE65基因的基因治疗药物Luxturna,但其售卖价格高达42万美元/针,是普通家庭难以承受的“天价”。为了改变这一现状,辉大基因等同类公司在加速研发LCA的基因疗法。
据姚璇博士介绍,辉大基因的LCA2管线预计今年底提交IND,在体内试验的安全性和有效性上,“我们采用了一种新的AAV血清型递送RPE65基因,在动物体内的试验数据显示,其使用剂量是现有疗法的1/100-1/10,可在动物模型中达到相似的治疗效果。”
低剂量,一方面意味着CMC的压力会降低,无需大规模就可生产出足够的样品进行研发,以降低药品生产成本;另一方面也更利于患者的安全。
辉大基因针对老年湿性黄斑变性(wet AMD)的基因治疗管线,是通过高保真版Cas13X靶向基因VEGFA,降低VEGFA的表达量,目前正在研发过程中,预计2023年初提交IND;该疗法已在动物试验中积累了近一年的安全性和有效性数据。
据了解,目前治疗老年湿性黄斑变性的单抗药物,约需每4-6周给药一次,存在用药依从性问题,给药过多也可能导致视网膜脱落等风险。目前,在非人灵长类实验中,辉大基因AAV递送药物的有效性可维持近一年,有望解决重复给药的问题。
此外,辉大基因在研管线还包括神经领域的罕见病:AS(天使综合征)、ALS(萎缩侧索硬化症,俗称渐冻症)、以及肌肉领域的杜氏肌营养不良症,听力障碍类疾病。
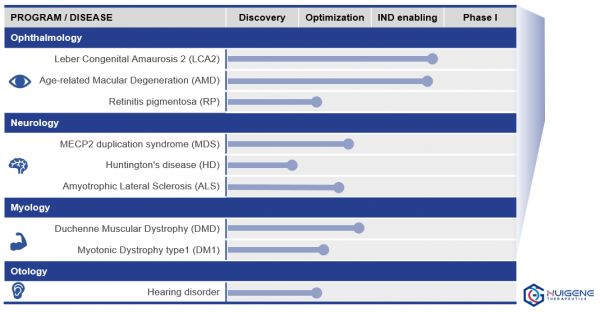
辉大基因在研管线示意图,企业供图
基因治疗的技术平台和团队
开发新药的链条中,从研发到放大生产工艺,涉及到多项技术突破。姚璇博士将辉大基因的技术平台归纳为:动物模型、基因编辑、递送系统、CMC(化学成分生产与控制);除了上述在基因编辑底层技术能力外,他也介绍了辉大在其它三个技术平台上的积累。
针对不同适应症研发新药时,首先要构建相应的动物疾病模型,用以在体内实验中验证药物的安全性和有效性。“杨辉教授在2013年时,就开始用CRISPR技术构建基因编辑动物,包括啮齿类小鼠以及非人灵长类猴子等。在此基础上,辉大在不同疾病领域构建多种动物模型用于管线研发。”
基因治疗研发过程中,“递送系统”是绕不过去的技术难点,当前辉大基因主要采用AAV病毒载体进行体内递送,针对不同类型疾病,开发高安全性、低免疫原性、高组织特异性的AAV载体。
在生产方面,其搭建了质粒工艺平台、AAV工艺平台以及分析检测平台,初步完成了50L悬浮培养的工艺摸索以及数十种分析方法的建立;通过不断优化,将促进目标产品的产量符合需求,质量符合标准。
在生物医药行业融资遇冷,资本市场趋于理性的行情下,辉大基因于2022年5月完成数亿元C轮融资。为什么能够获得机构持续的投资,对此姚璇博士认为,核心在于辉大基因在CGT领域的差异化,基因编辑工具之于CGT行业,如同汽车的发动机、芯片的技术。“现阶段公司在底层工具和管线研发技术上,具备竞争力;同时也在完善CMC工艺开发、临床研究等团队,丰富研发管线布局,改进新技术平台、新递送系统。”
姚璇博士表示,未来3-5年中国基因编辑、基因治疗领域应该会有持续突破和发展。辉大基因正开放基因编辑工具能力,希望能和更多生物创新药企、基因检测公司及各领域专家建立合作,共同将中国市场空间做大。
相关推荐
用基因编辑治疗人类罕见遗传病,「辉大基因」获得逾亿元A轮融资
致力基因治疗药物开发,「辉大基因」完成4亿元B轮融资
「微光基因」完成近亿元天使轮融资,推进新型基因编辑工具研发
36氪首发 | 获数亿元A轮融资,「至善唯新」要加速推进基因疗法管线
攻克碱基基因编辑核心技术,「正序生物」要为遗传病患者提供突破性疗法
36氪首发 | 「Exegenesis Bio」获数千万美元B+轮融资,推进多款基因疗法管线
聚焦罕见病基因治疗,「锦篮基因」完成近亿元天使轮融资
36氪首发 | 「尧唐生物」获数千万级天使轮融资,开启LNP递送体内基因编辑新时代
聚焦基因编辑疗法,「瑞风生物」完成近亿元A轮融资
36氪首发 | 「正序生物」获近3亿元新一轮融资,加速研发碱基编辑疗法
网址: 36氪专访 | 手握基因编辑工具IP,辉大基因如何加速基因治疗管线研发? http://m.xishuta.com/newsview64881.html