《科学》杂志11篇论文轰炸:人类有什么特别的?
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:学术经纬,原文标题:《〈科学〉重磅专题:11篇论文齐发!理解人类的新时代,来了!》,题图来自:《超体》
人类究竟有什么特别的?很多哲学家曾试图回答过这个问题。二十多年前,随着科学家首次解码人类等生物的完整遗传密码,我们开始从自己和其他动物的基因组中探寻人之所以为人的答案。
一个名为Zoonomia Project的大型国际研究项目从2006年搜集样本,对数百种哺乳动物的基因组序列开展测序,以及更重要的,对测序结果进行解读和系统比较,旨在从分子、种群和物种水平的变化,揭示人类和其他哺乳动物的基因组在演化过程中如何发展,哪些区域在哺乳动物中具有关键功能,哪些基因变化导致了物种独有的特征,哪些突变带来了疾病风险,等等。
今日,这项二十年磨一剑的工作,迎来里程碑式爆发。顶尖学术期刊《科学》本期以封面专刊的形式发表了Zoonomia项目的系列报道,包括11篇研究论文和2篇专家评论。
在这组论文中,来自全球50个科研机构的上百位研究人员构建了现今最大的哺乳动物比较基因组数据集,包含240种有胎盘哺乳动物的全基因组资源。通过详尽地调查和比对,他们获得了一系列前所未有的洞见,包括从猿到人的演化创新、人类疾病背后的遗传根源,以及有些动物如何获得特殊能力,如何判断一个物种是否有灭绝风险等。

Zoonomia项目构建了240种哺乳动物的全基因组资源,图中亚马孙河的海豚是该项目包含的52种濒危物种之一(图片来源:Marcos Amend)
《科学》专题指出:Zoonomia项目预示着一个新的时代,在这个时代,来自数百个物种的基因组的联合产物 将为理解哺乳动物、哺乳动物的进化和我们自己打开新的大门。
最重要和最特别的
人类基因组包含大约2万个基因,它们构成了制造人体所有蛋白质的代码。除此以外,基因组还包含很多指令,指导基因在何处、何时以及产生多少蛋白质,这些部分被称为调控元素,比编码蛋白质的部分更难识别。
而将240种哺乳动物的基因组放在一起进行比较后,那些在千万年进化过程中始终被保留下来的(用研究者的话说,更受“进化约束”),也就是基因组中最基础、最不可更改的关键序列就可能浮现出来。与之相反,突然在一个或少数分支开始积累突变的序列,也可能让我们窥见演化如何发挥创新。
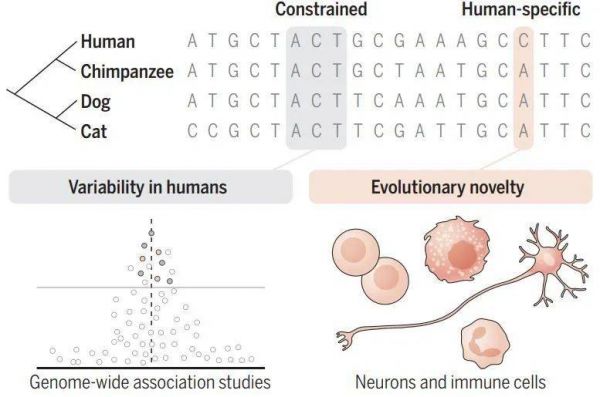
通过比对哺乳动物基因组序列中变与不变的密码产生洞见(图片来源:参考资料[2])
其中一篇论文指出,人类基因组中有360多万个位点是完全保守的,几乎是过去预测的2倍。科学家们计算发现,人类基因组有至少10%的区域受到进化约束,也就是在不同哺乳动物之间高度保守。引人注意的是,这些保守位点大部分并不在编码蛋白质的基因区域。
其中,超过4500个调控元件是“超保守元件”,即在所研究的98%以上的哺乳动物物种中几乎完全没有变化。这些区域大多参与了胚胎发育和RNA表达的调控。相反,那些变异频繁、快速进化的区域往往塑造了动物如何与环境互动,例如免疫应答或皮肤发育。
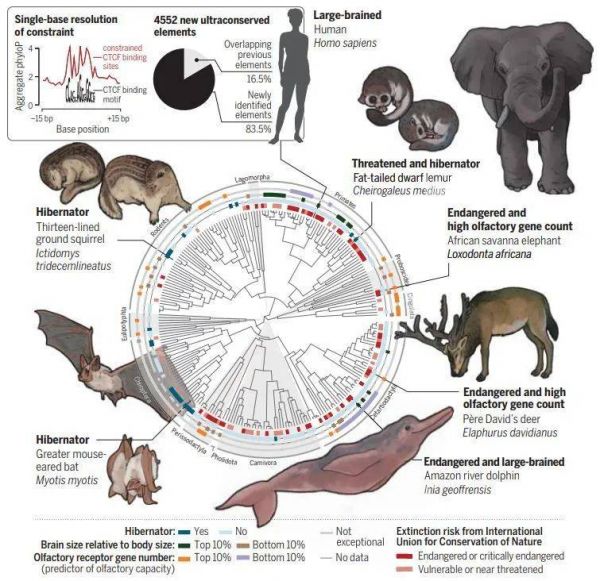
以单碱基分辨率识别哺乳动物基因组中的保守序列(图片来源:参考资料[7])
通过将基因组数据与表型注释配对,研究人员还在基因组中找出了一些元素,决定了有些动物具备与众不同的特点。例如,为什么人和海豚的脑子特别大,为什么十三条纹地松鼠会冬眠,为什么非洲象嗅觉特别灵敏,为什么有些蝙蝠会回声定位。
增进对疾病的理解
通过查找基因组中最为保守(也就是最受进化约束)的区域,另一篇论文重点分析了Zoonomia项目的数据如何促进我们对疾病的理解,尤其找出与各种疾病具有因果关系的突变。
研究指出,导致常见疾病的很大一部分突变发生在基因以外的区域,与基因的调控有关。“对240种哺乳动物的分析使我们深入了解基因组中的调控信号。”论文主要作者之一Jennifer Meadows博士说。
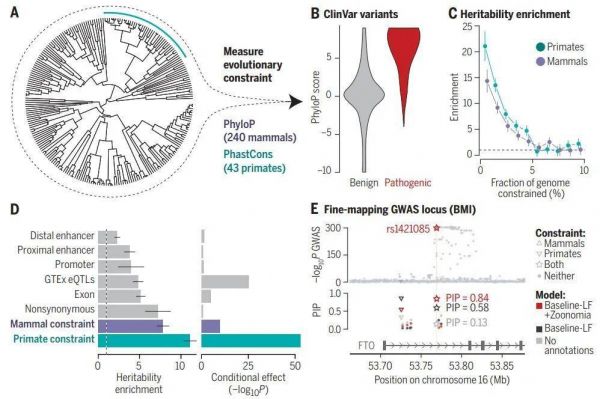
通过基因组中的进化约束找出与人类疾病有关的变异(参考资料[8])
以髓母细胞瘤为例,这是在儿童中最常见的一种恶性脑瘤。而研究者就在患者的基因组中发现,很多进化保守的位置上出现了许多新的突变。
研究者根据已知导致疾病的位点校准了所得的结果,再根据所得信息寻找更多可能导致疾病的其他位点,尤其是神经系统疾病(例如精神分裂症)和免疫系统疾病(例如哮喘、湿疹)。这些线索将有助于确定导致疾病的根源,为开发新的诊断和治疗方法奠定基础。
人脑进化的催化剂
人类引以为傲的大脑是如何演化出来的?此次发表的一项新研究指出,一百多万年前,由于卵子或精子形成过程中的偶然事件,人类祖先的基因组发生过大型结构变化,这种变化可能是人类大脑最终有别于其他灵长类动物的基础。
来自美国格莱斯顿研究所(Gladstone Institute)的科学家们重点分析了一种被称为“人类加速区(HARs)”的DNA短片段。所有人类之间的HARs几乎完全一样,但人类和所有其他哺乳动物之间的HARs则不同。这类片段大多作为增强子,调控与大脑发育相关的基因的活动水平。
对不同哺乳动物基因组中的HARs及其周围区域进行比较分析后,新研究分析发现,人类HARS所在的区域往往发生过严重的结构变异,导致人类基因组的三维折叠方式与其他灵长类动物不同。而折叠方式的变化,把不同的基因带到了HARs附近受其控制。某些情况下,受控基因在大脑发育中发挥作用;某些情况下,受控的基因与神经发育或精神疾病有关。
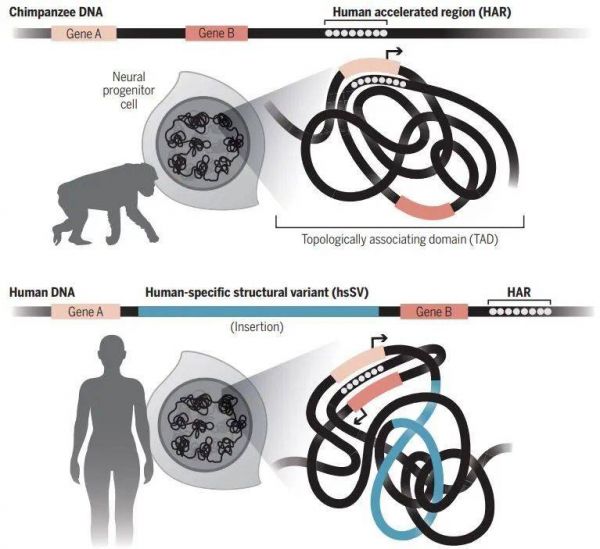
比较人与黑猩猩的HARs:由于结构变异,基因组的折叠方式改变,HARs可调控的基因不同,而这些基因多与大脑发育有关(图片来源:参考资料[5])
未完待续
在Zoonomia项目此次发表的论文中,有几项研究重点关注了人类基因组中调控元件的演变,以及可在基因组中移动的DNA序列(转座子);还有一些科学家分析了人类特有的1万多个基因缺失,并发现其中一些与神经元的功能有关。围绕哺乳动物如何适应环境的多篇论文表明,哺乳动物的多样性早在恐龙大规模灭绝之前就已开始布局;利用基因组学资源,我们还能解释特定的基因变异如何让雪橇犬能够在恶劣环境中生存。
尽管一口气发表了11篇论文,科学家们表示,这些对于我们理解自身的起源与疾病、理解生命的多样性来说还只是回答了一小部分。其中两篇论文的通讯作者、生态学和演化生物学家Beth Shapiro教授指出:“这11篇论文只是一个样本,显示了利用新的遗传数据可以完成的科学类型。”
该项目主要负责人之一、瑞典乌普萨拉(Uppsala University)的Kerstin Lindblad-Toh教授表示,Zoonomia项目产生的数据可用于未来许多年的演化研究和医学研究。届时,我们将对人类和生命的进化与产生有更透彻的理解。
参考资料:
[1] Genomics expands the mammalverse. Doi: 10.1126/science.add2209
[2] Seeing humans through an evolutionary lens. Doi: 10.1126/science.adh0745
[3] G. Andrews et al., Science (2023) Mammalian evolution of human cis-regulatory elements and transcription factor binding sites. DOI: 10.1126/science.abn7930
[4] K. L. Moon et al., Science (2023) Comparative genomics of Balto, a famous historic dog, captures lost diversity of 1920s sled dogs. Doi: 10.1126/science.abn5887
[5] I. M. Kaplow et al., Science (2023) Relating enhancer genetic variation across mammals to complex phenotypes using machine learning. Doi: 10.1126/science.abm7993
[6] N. M. Foley et al., Science (2023) A genomic timescale for placental mammal evolution. Doi: 10.1126/science.abl8189
[7] M. J. Christmas et al., Science (2023) Evolutionary constraint and innovation across hundreds of placental mammals. Doi: 10.1126/science.abn3943
[8] P. F. Sullivan et al., Science (2023) Leveraging base-pair mammalian constraint to understand genetic variation and human disease. Doi: 10.1126/science.abn2937
[9] B. M. Kirilenko et al., Science (2023) Integrating gene annotation with orthology inference at scale. Doi: 10.1126/science.abn3107
[10] J. R. Xue et al., Science (2023) The functional and evolutionary impacts of human-specific deletions in conserved elements. Doi: 10.1126/science.abn2253
[11] K. C. Keough et al., Science (2023) Three-dimensional genome rewiring in loci with human accelerated regions. Doi: 10.1126/science.abm1696
[12] A. B. Osmanski et al., Science (2023) Insights into mammalian TE diversity through the curation of 248 mammalian genome assemblies. Doi: 10.1126/science.abn1430
[13] A. P. Wilder et al., Science (2023) The contribution of historical processes to contemporary extinction risk in placental mammals. Doi: 10.1126/science.abn5856
[14] Genomes from 240 mammal species explain human disease risks. Retrieved Apr. 27, 2023 from https://www.eurekalert.org/news-releases/987065
[15] Study suggests catalyst for human brain evolution. Retrieved Apr. 27, 2023 from https://www.eurekalert.org/news-releases/986862
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:学术经纬
相关推荐
AI设计芯片的能力超越人类?谷歌《自然》论文遭加州大学研究团队 “打脸”
我抄我自己的论文,能算侵权吗?有学者做了一份论文复用指南
人类肿瘤里发现大量细菌,它们究竟在做什么?
全球首个“人-猴混合胚胎”成功存活了20天,有什么意义?
400多篇论文被曝造假,“论文作坊”真面初现?
《自然》杂志论文:转基因酵母合成大麻素,产大麻如同酿啤酒
未来科学的进步,将取决于人类还是AI ?
通过“生物追踪”获得数据,科学家有了预测癌症的新方法
甜过初恋!浙大博士用200个西瓜130页论文,教你用机器学习科学挑瓜
你的论文 “后劲儿” 有多大?AI预知模型告诉你
网址: 《科学》杂志11篇论文轰炸:人类有什么特别的? http://m.xishuta.com/newsview72954.html